Компания Roche останавливает исследовательскую программу по препарату Олезоксим
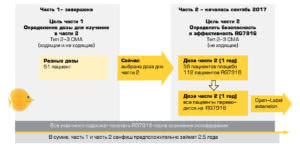
Фармацевтическая компания Roche распространила официальное сообщение о закрытии своей программы по разработке препарата Олезоксим (olesoxime), предназначенного для терапии СМА.