На сегодняшний момент на территории России зарегистрированы три лекарственных препарата для патогенетического лечения спинальной мышечной атрофии: нусинерсен (Спинраза), рисдиплам (Эврисди) и онасемноген абепарвовек (Золгенсма) В зарегистрированных инструкциях по применению лекарственных средств содержится в том числе информация об одобренных показаниях к применению и ограничениях в применении лекарственных средств.
В этом разделе мы собрали краткую информацию о данных лекарственных средствах и возможностях доступа к ним.
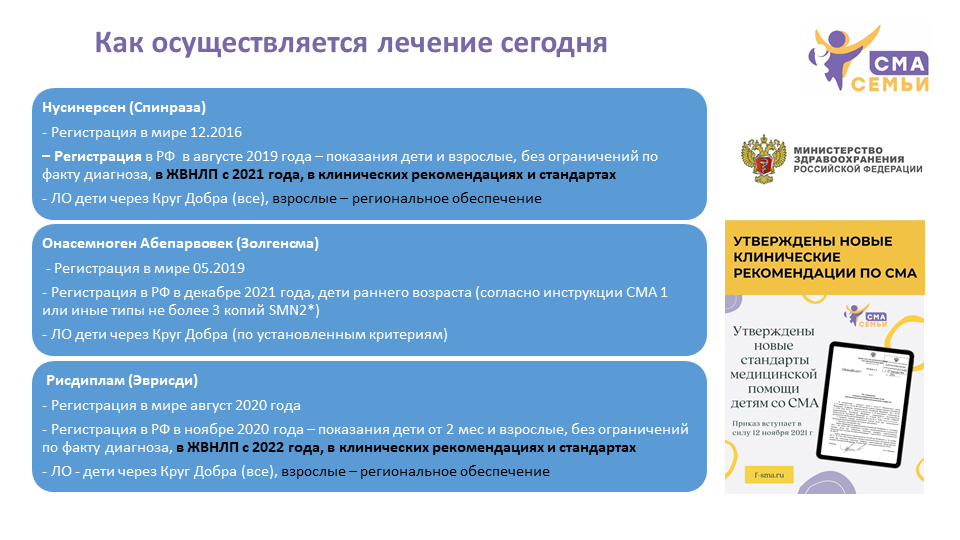
Нусинерсен (Спинраза)
Нусинерсен — первый препарат для патогенетического лечения СМА, одобренный к применению в мире. Впервые препарат был одобрен в конце декабря 2016 года в США, летом 2017 года в Европе.
В конце 2018 года нусинерсен был подан на регистрацию в России. 13 февраля 2019 года препарат получил в России орфанный статус. 16 августа 2019 года препарат был официально зарегистрирован в России и одобрен для применения у пациентов со СМА без ограничения по типу или возрасту.
В системе Государственного реестра лекарственных препаратов нусинерсену присвоен номер ЛП-005730. Инструкция к лекарственному препарату
В апреле 2019 года в России стартовала программа раннего доступа к препарату нусинерсен компании Биоген. С июля 2019 года в рамках этой гуманитарной программы производителя бесплатно годовой курс лечения получили 41 пациент со СМА с ранним началом в возрасте до 3 лет. Первые результаты применения препарата были опубликованы российскими врачами.
В апреле 2020 года была подана заявка о включении Нусинерсена (Спинразы) в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП). В августе 2020 года на заседании комиссии Министерства здравоохранения Российской Федерации по формированию перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи было принято решение о рекомендации включения нусинерсен в перечень ЖНВЛП , и 23 ноября 2020 года Постановлением Правительства препарат Спинраза был включен в перечень ЖНВЛП с 2021 года Соответствующее распоряжение подписано Правительством РФ 23 ноября 2020 за номером 3073-р
В августе 2020 года Минздрав РФ утвердил новые клинические рекомендации по спинальной мышечной атрофии у детей, которые также включали рекомендации по применению нусинерсен. Обновление клинических рекомендаций вышло в 2021 году.
На сегодняшний момент доступ к лекарственному препарату осуществляется:
Для детей – за счет средств федерального бюджета через фонд «Круг добра» .
Для взрослых (старше 18 лет) – за счет средств регионального бюджета в соответствии с действующим законодательством.
Рисдиплам (Эврсиди)
Рисдиплам — первый препарат с пероральным способом приема для патогенетического лечения СМА. Впервые препарат был одобрен в начале августа 2020 года в США, в марте 2021 года в Европе.
18 марта 2020 года рисдиплам был подан на регистрацию в России. 26 июля препарат получил орфанный статус. 26 ноября 2020 года рисдиплам был зарегистрирован и одобрен в России для лечения СМА у взрослых и детей с двух месяцев.
В системе Государственного реестра лекарственных препаратов рисдипламу присвоен номер ЛП-006602. Инструкция к лекарственному препарату
В январе 2020 года в России стартовала программа дорегистрационного доступа к препарату рисдиплам компании Рош. Программа была открыта для пациентов со СМА1 (с 17 января 2020 года) и СМА2 типа (с 27 марта 2020 года). В рамках этой гуманитарной программы производителя бесплатно препарат рисдиплам получали более 230 пациентов (детей и взрослых) до момента регистрации и ввода в гражданский оборот.
В начале 2021 года была подана заявка о включении рисдиплам (Эврисди) в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП). В августе 2021 года на заседании комиссии Министерства здравоохранения Российской Федерации по формированию перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи было принято решение о рекомендации включения рисдиплам в перечень ЖНВЛП, и 23 декабря 2021 года Постановлением Правительства препарат Эврисди был включен в перечень ЖНВЛП с 2022 года. Соответствующее распоряжение подписано Правительством РФ 23 декабря 2021 за номером 3781-р .
Весной 2021 года Минздрав РФ утвердил обновленную версию клинических рекомендаций по спинальной мышечной атрофии у детей, в которую были включены рекомендации по применению рисдиплам
На сегодняшний момент доступ к лекарственному препарату осуществляется:
Для детей – за счет средств федерального бюджета через фонд «Круг добра».
Для взрослых (старше 18 лет) – за счет средств регионального бюджета в соответствии с действующим законодательством.
Онасемноген абепарвовек (Золгенсма)
Онасемноген абепарвовек (Золгенсма) — первый препарат генной терапии для патогенетического лечения СМА. Впервые препарат был одобрен в мае 2019 года в США, в мае 2020 года в Европе.
В середине июля 2020 года онасемноген абепарвовек был подан на регистрацию в России. 1 октября 2020 года препарат получил орфанный статус. 9 декабря 2021 года онасемноген абепарвовек (Золгенсма) был зарегистрирован и одобрен в России для лечения СМА у:
— пациентов со спинальной мышечной атрофией (СМА) с биаллельной мутацией в гене SMN1 и клиническим диагнозом СМА 1-го типа или
— пациентов со СМА с биаллельной мутацией гена SMN1 и не более чем тремя копиями гена SMN2
Иные особенности и ограничения применения лекарственного препарата указаны в инструкции к лекарственному препарату.
В системе Государственного реестра лекарственных препаратов Золгенсма присвоен номер ЛП-007675. Инструкция к лекарственному препарату.
В январе 2020 года компания Новартис запустила глобальную программу управляемого доступа к препарату. В рамках этой программы компания ежегодно обязалась распределять бесплатно до 100 доз препарата Золгенсма в течение года по всему миру для пациентов до 2 лет, подходящих под медицинские критерии и условия программы из тех стран, где Золгенсма все еще не одобрен для применения. Отбор пациентов для предоставления лечения по заявкам лечащих врачей в рамках программы проводится с помощью этически-спорного процесса «слепого отбора» или «лотереи». В августе 2021 года программа управляемого доступа к препарату была закрыта для России в связи с принятыми правилами аллокации. Одним из основных правил аллокации пациентов для участия в «розыгрыше» было условие, что на территории страны проживания пациента лечение препаратом AVXS-101 не возмещается за счет бюджетных средств или препарат не зарегистрирован. В России с конца июля пациенты со СМА получили возможность обеспечения за счет государственного фонда «Круг Добра» за счет бюджетных средств РФ. За полтора года работы программы в РФ лечение получили 22 пациента.
На сегодня препарат онасемноген абепарвовек не включен в перечень ЖНВЛП и не включен в действующие клинические рекомендации.
На сегодняшний момент доступ к лекарственному препарату осуществляется:
Для детей – за счет средств федерального бюджета через фонд «Круг добра» по установленным критериям
Данный материал носит исключительно информационный характер и не является рекламой. Рекомендации относительно индивидуального применения лекарственных препаратов следует получать у вашего лечащего врача. Информация о препаратах представлена исключительно с целью ознакомления.



