Бранаплам — экспериментальный препарат для лечения СМА. В клинических исследованиях должны участвовать младенцы до 6 месяцев со СМА I. Препарат разрабатывает компания Новартис.
Бранаплам имеет механизм действия, схожий с ранее разработанным препаратом Спинраза. Он увеличивает в организме больного количество белка, дефицит которого приводит к возникновению и развитию СМА. Препарат вводится перорально (через рот).
Клинические исследования препарата
В августе 2018 года в России в Екатеринбурге (на базе Детской городской клинической больницы №9) открылся первый российский центр клинических исследований препарата. Пациенты, отвечающие определенным критериям, список которых можно посмотреть здесь, участвуют в международном клиническом исследовании. Всего в России Бранаплам исследуется на базе 6 центров.
Препарат Бранаплам исследуется на безопасность и эффективность в многоцентровом международном клиническом исследовании фазы 1\2 на пациентах со СМА 1 типа, в исследовании могли принять участие младенцы младше 6 месяцев на момент начала участия.
Клинические исследования препарата проводятся в нескольких центрах в разных европейских странах, а также в 6 центрах на территории России.
В июле 2019 года компания Новартис объявила о завершении набора участников клинического исследования.
В программу 2 части исследования включено 25 малышей со СМА 1 типа. Помимо набранной группы в 1 части исследования принимают участие 7 детей (из 13 изначально включенных в эту часть) — что позволяет говорить о накопленном опыте применения препарата от 3 до 4 лет для участников 1 части.
Данные, которые исследователи планируют получить по итогам исследования этой фазы позволят принять решение о последующих исследованиях препарата.
В ноябре 2020 года Компания Новартис сообщила, что продолжает клинические исследования препарата бранаплам (LMI070), перорального модулятора сплайсинга SMN2 c приемом препарата один раз в неделю.
Данный материал носит исключительно информационный характер и не может служить рекламой. Рекомендации относительно индивидуального применения этого лекарства следует получать у вашего лечащего врача.
Другие статьи о препарате Бранаплам

В России открывается первый центр клинических исследований препарата Бранаплам
В середине августа в Екатеринбурге (на базе Детской городской клинической больницы №9) открывается первый российский центр клинических исследований препарата Бранаплам, предназначенного для терапии спинальной мышечной атрофии.
О Бранапламе, разработанном компанией Новартис и увеличивающем количество функционального белка SMN, продуцируемого геном SMN2, мы ранее писали/

Обновление информации по клиническим исследованиям компании «Новартис» в области СМА
Компания Новартис предоставила свежую информацию по клиническим исследованиям своего препарата Бранаплам, предназначенного для терапии спинальной мышечной атрофии. Бранаплам (LMI070) — пероральный препарат, который увеличивает количество функционального белка SMN, продуцируемого геном SMN2 (белок SMN поддерживает двигательные нейроны, которые контролируют активность мышц).
Обновление по программе клинических исследований препарата Бранаплам компании Новартис
Бранаплам — это пероральный препарат, находящийся в разработке на 1\2 фазе клинических исследований, основной целью исследований на этой фазе является оценка безопасности и эффективности препарата у пациентов со СМА 1 типа.
Последние публикации о лекарствах и клинических испытаниях
Биоген представил первые результаты исследования DEVOTE применения повышенных дозировок нусинерсена для лечения СМА
На прошедшем 8-12 октября 2024 года в Праге Конгрессе World Muscle Society компания Биоген представила первые результаты части B и C исследования фазы 2/3 DEVOTE7., которое изучало применение более высокой дозы нусинерсена по сравнению с одобренной и применяющейся сейчас для лечения людей со СМА.

Рош представил результаты 2-летнего исследования RAINBOWFISH применения рисдиплама у пресимптоматических младенцев со СМА
Компания Рош представила новые данные своих исследований на 29-м ежегодном конгрессе World Muscle Society, прошедшего в Праге 8-12 октября 2024 года. На конгрессе были представлены

Представлены результаты долгосрочного приема рисдиплама у детей со СМА 1 типа в течение 5 лет
Компания Рош представила новые финальные данные 5-летнего наблюдения в рамках основного клинического исследования FIREFISH (NCT02913482). Данные были представлены на прошедшей в начале июня конференции Cure SMA Research & Clinical Care Meeting 2024 в Техасе (США).
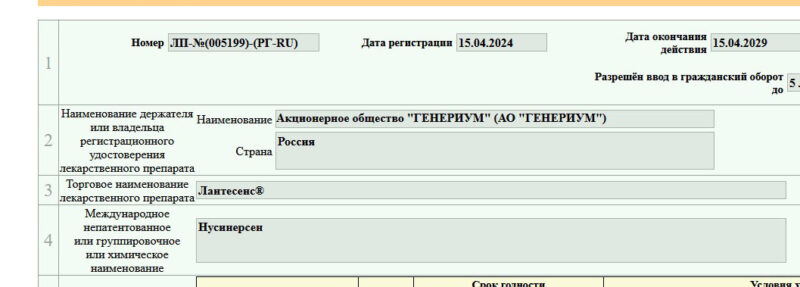
В России зарегистрирован еще один препарат для лечения спинальной мышечной атрофии
Минздрав зарегистрировал в России препарат Лантесенс — отечественный аналог Спинразы (международное непатентованное наименование – нусинерсен), применяемого для терапии всех типов спинальной мышечной атрофии у детей и взрослых.

Обновлены критерии участия в клиническом исследовании BLUEBELL препарата генной терапии ANB-004 российской компании BIOCAD
Данный материал носит исключительно информационный характер и не является рекламой. Рекомендации относительно индивидуального применения лекарственных препаратов следует получать у вашего лечащего врача.

Пероральная терапия NIDO-361 для спино-бульбарной мышечной атрофии успешно завершила 1 фазу клинических исследований
NIDO-361, экспериментальное пероральное средство от спино-бульбарной мышечной атрофии (СБМА или болезнь Кеннеди) компании Nido Biosciences, оказалось в целом безопасным и хорошо переносимым у здоровых взрослых, принявших участие в клиническом исследовании фазы 1(ACTRN12622000964718). Его результаты были представлены во время Международной конференции по болезни Кеннеди в ноябое 2023 года в Лондоне.

