Использование рисдиплама после лечения генной терапией: доступные научные данные
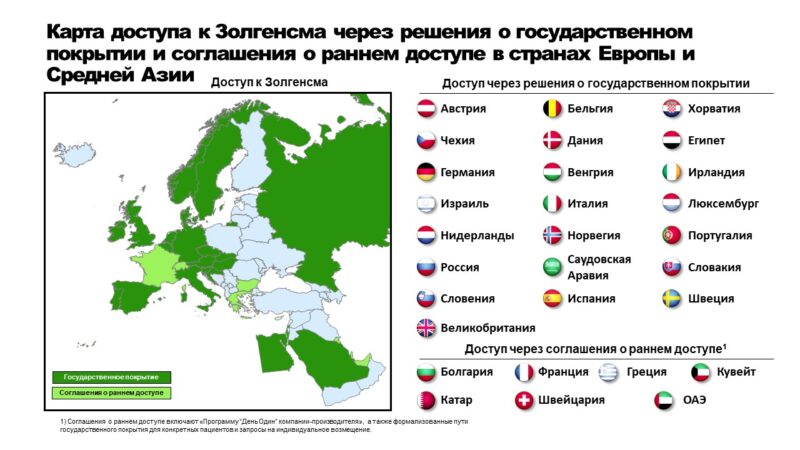
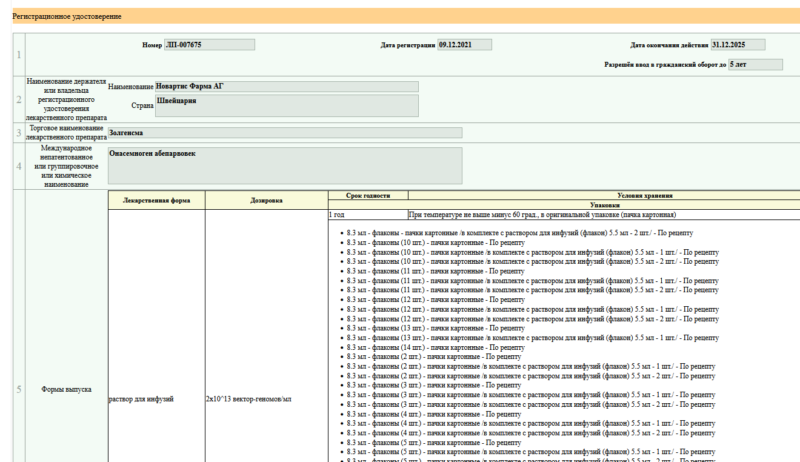
Вопросы использования препаратов патогенетического лечения, влияющие на возможности гена SMN2 увеличивать выработку белка SMN (нусинерсен, рисдиплам) после предшествующего однократного лечения препаратом генной терапии (онасемноген абепарвовек) на сегодня являются одними из наиболее обсуждаемых.