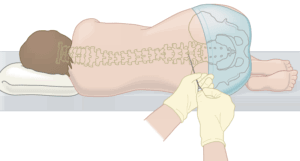
Лечение СМА — как получить в России
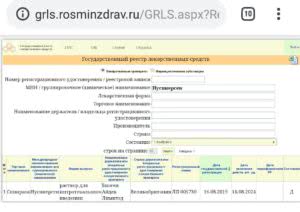
Наш фонд и волонтер-юрист с большим опытом в медицинской сфере подготовили информационный материал, который поможет больным СМА и членам их семей разобраться в нюансах получения доступа к препарату Нусинерсен (Спинраза). Скачать материал можно по ссылке.