На этой странице вы найдете все материалына сайте из нескольких разделов, сгруппированные по дате публикации. Мы благодарим вас за то, что нашли время заглянуть сюда.
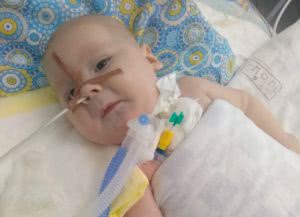
Мешок Амбу и буклеты помогут малышу Артёму из Омутнинска и его маме
«Мы искренне хотим поблагодарить вас за своевременно предоставленную нам помощь! спасибо вам от чистого сердца».

В Петербурге для детей со СМА открыты бесплатные занятия в бассейне
Дорогие родители детей со СМА, живущие в Петербурге. Благотворительный фонд «Александра» и оздоровительный центр «Реасан» приглашает детей со СМА от 5 до 15 лет на бесплатные занятия в бассейне.
Если ваш ребенок хочет научиться плавать или уже плавает, вы можете оставить заявку на посещение занятий по ссылке.
Если ваш ребенок хочет научиться плавать или уже плавает, вы можете оставить заявку на посещение занятий по ссылке.
Заявку можно оставить до 1 декабря.

Врач как союзник в борьбе с болезнью. Интервью с Ольгой Германенко, директором Благотворительного фонда «Семьи СМА»
Если у любой нашей семьи есть вопрос или конкретная проблема, всегда можно обратиться в фонд, и, в зависимости от имеющихся ресурсов и возможностей, мы стараемся не оставить без поддержки.

Компания «Янссен» ответила на вопросы по лекарственной терапии с использованием препарата Нусинерсен
Регистрация препарата нусинерсен для лечения спинальной мышечной атрофии СМА — это безусловно важный шаг для доступа больных к патогенетическому лечению, и совместно с компанией Biogen мы стремимся сделать эту инновационную терапию доступной для российских пациентов и помочь им повысить качество жизни.

С 18 по 20 ноября в Екатеринбурге пройдет «Школа СМА»
С 18 по 20 ноября 2019 года в Екатеринбурге пройдет «Школа СМА» с участием итальянских специалистов из центра SAPRE Кьяра Мастелла и Катя Альберти, респираторный специалист Андреа Вольфлер и ортопед Романо Сальси, а также физический терапевт Мэрион Мейн из Великобритании.

Малышам со СМА нужны пульсоксиметры
Сейчас Никите и другим малышам очень нужен пульсоксиметр. Он постоянно следит за уровнем кислорода в крови и помогает родителям быстро понять, когда у ребенка накопилась мокрота. Дешевые пульсоксиметры, которые надеваются на палец, не могут постоянно контролировать ситуацию, поэтому мы просим помочь Никите и остальным детям со СМА вовремя избавляться от мокроты. Это убирает риск осложнений, ребенок меньше болеет, а это значит, что у него больше сил для борьбы с болезнью.

У маленького Никиты из Ярославской области теперь есть отсасыватель
Мама Никиты — Евгения благодарит всех жертвователей.
Огромное спасибо фонду «Семьи СМА» за помощь в приобретении аспиратора и всего необходимого для облегчения жизни нашего малыша!!!
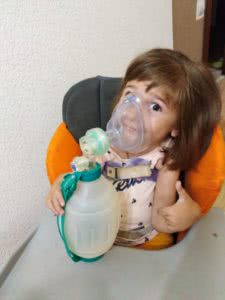
Спасибо жертвователям Добромейл за 20 мешков Амбу и 20 отсасывателей
«Мешок Амбу — это скорая помощи на все случаи жизни. Он всегда у нас в машине. Без него никуда нельзя уйти или уехать. Нужно делать 200 вдохов в день, чтобы легкие дочки наполнялись воздухом».
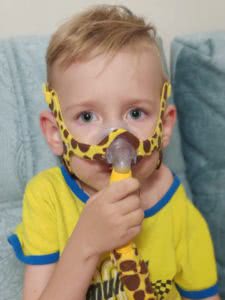
Спасибо за маски для аппарата неинвазивной вентиляции легких
Василине и Арсению на прошедшей в выходные Школе СМА в Новосибирске Василий Штабницкий настроил аппараты вентиляции легких, и теперь мы спокойны за их дыхание.
А Феде аппарат настроили на Школе в Краснодаре в марте, и дело оставалось за малым — за новой маской, взамен старой, пришедшей почти в полную негодностью.

Итоги проекта «Обучение и развитие за 2018 год»
Цифры можно увидеть на картинке, а цель этого проекта фонда — научить врачей и родителей квалифицированно помогать и поддерживать людей со СМА. Важно передать опыт врачей и сотрудников фонда врачам и родителям для создания системы поддержки пациентов.

В России начали проводить скрининг новорожденных на спинальную мышечную атрофию
Такая программа значит, что выявленные еще до появления первых симптомов болезни малыши со СМА — будут иметь больше шансов на вовремя начатое лечение. А по данным исследований, чем раньше начата терапия СМА — тем больше шансов на здоровое будущее и меньшие последствия заболевания.

Документально оформленный паллиативный статус у пациентов со СМА не является препятствием для получения лекарственной терапии и реабилитации
Пациенты с оформленным паллиативным статусом (через оформленный протокол ВК) имеют право получать патогенетическую лекарственную терапию и обеспечиваться необходимым поддерживающим респираторным оборудованием одновременно. Наличие документально оформленного паллиативного статуса у больного препятствием к получению лекарственной патогенетической терапии и реабилитации не является.
Компания Biogen объявила о запуске нового клинического исследования DEVOTE препарата Нусинерсен
18 сентября 2019 года компания Biogen в своем официальном письме в ассоциацию «СМА Европа» объявило о запуске о запуске нового клинического исследования DEVOTE препарата Нусинерсена (Спинразы). Цель исследования — изучить потенциал повышения эффективности, а также безопасности и переносимости при введении более высокой дозы.

Новые данные промежуточных результатов исследования NURTURE препарата Нусинерсен на досимптоматической стадии СМА
2 сентября 2019 года компания Biogen сообщила о предварительных результатах исследования NURTURE. Исследование NURTURE — это находящееся на второй фазе продолжающееся открытое исследование препарата Нусинерсен (Спинраза) с участием 25 пациентов с генетически подтвержденным диагнозом спинальная мышечная атрофия (СМА), которые получили первую инъекцию до шести недель жизни предсимптоматически (т.е. до момента проявления первых симптомов заболевания).

AveXis представил новые данные по генной терапии СМА
Новые промежуточные данные из исследования SPR1NT подтверждают критическую важность раннего начала терапии у пациентов с досимптоматической СМА, приводящей к развитию двигательных навыков «по возрасту».

Опубликован годовой отчет фонда за 2018 год
Ольга Германенко в отчете о работе фонда за 2018 год очень точно рассказала о том, что мы чувствуем почти каждый день. Очень хочется помочь всем людям со СМА в России. Хочется, чтобы каждый ребенок и взрослый мог жить, учиться, работать, радоваться и встречаться с друзьями.

Юридическая служба по лекарственной терапии
Консультант может использовать свой опыт, знания, поддержку юристов, обязательно будет активно вовлекаться в решение проблем — но не сможет сделать все за пациентов. Получение терапии СМА – это трудный путь и в первую очередь большая работа самого пациента и его семьи. Это наше с вами сотрудничество и помощь друг другу, обмен информацией и взаимная поддержка.

Новартис предоставил новые данные о разработке препарата LMI070 (Бранаплам) для СМА 1 типа.
Результаты исследования на животных, которое использовало ежедневное дозирование в течение года в сравнении с еженедельным дозированием в этом исследовании на человеке, выявили непредвиденные поражения периферических нервов и спинного мозга, а также семенников и почечных сосудов.

