26 ноября 2020 года в России был зарегистрирован и одобрен для применения второй препарат для лечения спинальной мышечной атрофии (СМА) — рисдиплам (Эврисди). Информация об этом была добавлена в Государственный реестр лекарственных средств (регистрационный номер ЛП-006602)
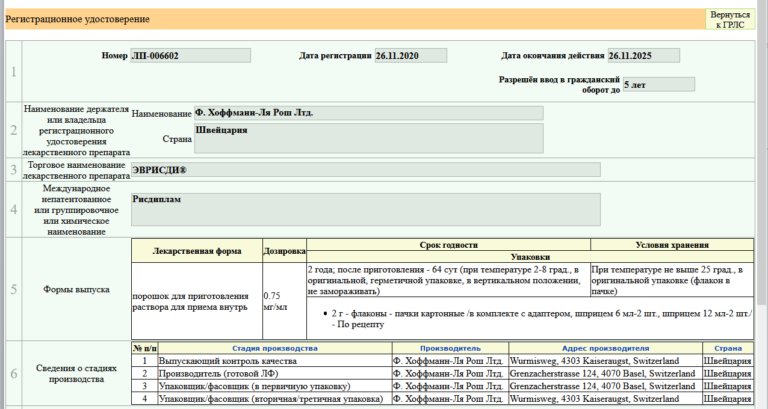
Эврисди стал вторым лекарственным препаратомт, зарегистрированным в РФ, действие которого и направлено на механизм развития заболевания и предназначенный исключительно для патогенетического лечения СМА. Согласно утвержденной инструкции к препарату — Министерство здравоохранения РФ одобрило препарат рисдиплам для лечения спинальной мышечной атрофии (СМА) у взрослых и детей с двух месяцев. Таким образом, может применяться без ограничения по типу заболевания в соответствии с назначением врача.
Рисдиплам является модификатором сплайсинга (генетической модификации) гена SMN2, увеличивающим экспрессию полноразмерных функциональных белков SMN. Рисдиплам применяется перорально, минует гематоэнцефалический барьер (ГЭБ) и системно воздействует на центральную и периферическую нервную систему. Он был разработан компанией Roche в сотрудничестве с PTC Therapeutics и SMA Foundation.
Регистрационное досье на данный лекарственный препарат было представлено в Министерство здравоохранения РФ в марте 2020 года и спустя 8 месяцев препарат был зарегистрирован по ускоренной процедуре в соответствии с присвоенным ранее статусом орфанного лекарственного препарата.
.
Краткие ответы на часто задаваемые вопросы:
Общая информация о препарате
- Рисдиплам стал вторым зарегистрированным в России лекарственным препаратом для лечения СМА (первый препарат — нусинерсен был зарегистрирован в 2019 году.
- Зарегистрирован для лечения спинальной мышечной атрофии у взрослых и детей с двух месяцев (показания к применению аналогичные зарегистрированным FDA в США в августе 2020 года).
- Рисдиплам (торговое наименование Эврисди®) создан для лечения СМА путем повышения в организме уровня белка выживаемости двигательных нейронов (SMN).
- пока рисдиплам — первый и единственный препарат для лечения СМА, который можно принимать на дому, т.к. выпускается в форме порошка для приготовления сиропа. Он применяется в жидкой форме один раз в сутки перорально или, при необходимости, через зонд или гастростому.
- принимать его нужно ежедневно в течение всей жизни.
- В клинических исследованиях подтверждено улучшение двигательных функций у пациентов разных возрастов со СМА 1-го, 2-го и 3-го типов. В исследованиях принимали участие более 450 пациентов со СМА возрастом от 2 мес до 60 лет.
О продолжении терапии пациентов со СМА, начавших прием препарата в рамках программ клинических исследований и программы дорегистрационного доступа
- С начала 2020 года в России производителем была открыта программа дорегистрационного доступа, в рамках которой больные со СМА1 и 2 типов могли бесплатно получать лечение до регистрации препарата в стране
- Около 230 больных СМА были включены в глобальную программу дорегистрационного доступа к препарату рисдиплам по жизненным показаниям. Среди них более 70 пациентов со СМА 1-го типа и около 160-ти со СМА 2-го типа.
- По сообщению компании, участники программы дорегистрационного доступа к рисдипламу продолжат получать препарат за счет средств компании «Рош» до его ввода в гражданский оборот (обычно это занимает примерно 3-6 месяцев с момента регистрации).
- По сообщению компании-производителя, ожидается, что первые партии препарата рисдиплам поступят в гражданское обращение в России в мае 2021 года.
- Участники программ клинических исследований продолжат получать препарат в рамках открытых фаз продолженного наблюдательного исследования.
Краткая информация о результатах клинических исследований
- В регистрационной заявке на рисдиплам были представлены данные клинических исследований с участием пациентов, представляющих различные возрастные группы и страдающих заболеванием различной степени тяжести, включая СМА 1-го, 2-го и 3-го типов.
- Так, в исследовании FIREFISH с участием пациентов со СМА 1-го типа в возрасте 2–7 месяцев, спустя 2 года после начала лечения 88% пациентов были живы без постоянной вентиляции легких. 59% пациентов, получавших терапевтическую дозу, достигли способности сидеть без поддержки в течение не менее 5 секунд — ключевой этап развития моторной функции, который обычно не наблюдается при естественном течении болезни. 65% пациентов могли удерживать голову в вертикальном положении, 29% могли переворачиваться, и 30% могли стоять с поддержкой. 100% пациентов сохранили способность глотать, 93% сохранили способность питаться перорально.
- В исследовании SUNFISH у детей и взрослых со СМА 2-го или 3-го типов в возрасте от 2 до 25 лет, спустя 2 года после начала лечения наблюдалось клинически и статистически значимое улучшение двигательной функции по сравнению с плацебо.
- В исследовании JEWELFISH с участием пациентов со СМА в возрасте от 6 месяцев до 60 лет, ранее получавших другие препараты патогенетического лечения (спинраза, золгенсма, олезоксим), применение риcдиплама привело к быстрому и устойчивому повышению уровня в организме белка SMN. Исследование продолжается.
- Наиболее частыми нежелательными явлениями при позднем начале СМА, а также при СМА с дебютом в младенческом возрасте были диарея и сыпь. Они разрешались несмотря на продолжающееся лечение.
О статусе регистрации в мире
- Кроме России, в настоящее время препарат рисдиплам разрешен к применению в США, Бразилии, Чили, Украине, Южной Корее и Грузии. Заявки на регистрацию находятся на рассмотрении регуляторных органов Европейского союза, Швейцарии, Японии, Китая, Израиля и еще 15 стран мира.
Регистрация еще одного лекарственного препарата для лечения СМА в стране — это очень важный, критический и необходимый этап для обеспечения доступа нуждающихся к лечению. Одобрение рисдиплама, как препарата патогенетической терапии, сможет стать еще одним шагом к доступному лечению и создаст условия для более широкого применения эффективных лекарственных средств у пациентов, которые в них нуждаются в дополнение к ранее зарегистрированному лечению. И это еще один шаг на пути реального доступа к лечению для каждого больного СМА в стране. Нам предстоит впереди решение еще очень многих вопросов для того, чтобы патогенетическая терапия была своевременна и доступна для каждого нуждающегося пациента.
Важно, чтобы препараты не только регистрировались, но и у всех пациентов был доступ и возможность получать жизненно-необходимое лечение и государство предоставляло такую возможность
Данный материал носит исключительно информационный характер и не может служить рекламой, как и не призывает использовать данное зарегистрированное в РФ лекарственное средство. Любую информацию и индивидуальные рекомендации относительно применения этого или любого иного лекарственного препарата необходимо получать у вашего лечащего врача.



