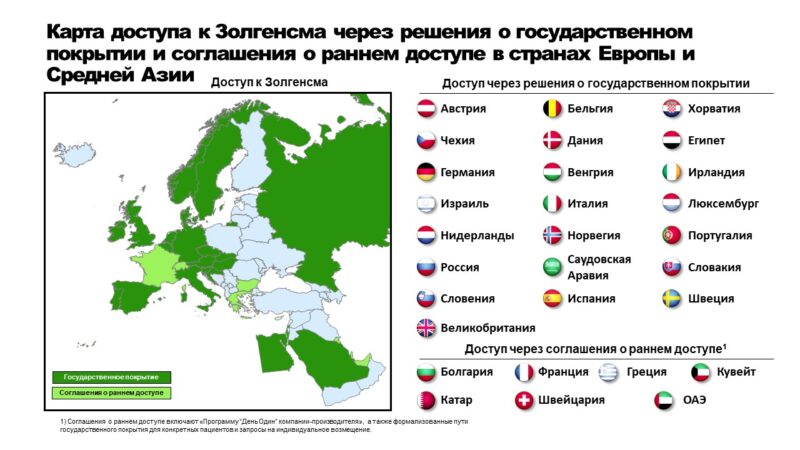
Данные показывают, что препарат Золгенсма безопасен для детей с более тяжелым весом, чем в клинических исследованиях
Препарат онасемноген абепарвовек (Золгенсма) в целом безопасен и хорошо переносится пациентами со спинальной мышечной атрофией (СМА) с массой тела 8,5 кг и более, при этом в группе более тяжелых по весу пациентов не выявлено новых проблем безопасности.
8,5 кг были максимальным весом пациентов со СМА, включенных в клинические испытания препарата, на основании которых происходило одобрение для лечения детей со СМА.