Спинраза (Nusinersen)
Спинраза — это первый в мире препарат для лечения спинальной мышечной атрофии (СМА). Препарат увеличивает производство белка SMN из «резервного» гена SMN2 с использованием так называемых антисмысловых олигонуклеотидов. Спинраза останавливает прогрессирование заболевания, отмирание нейронов спинного мозга прекращается.
При раннем начале терапии прогноз наиболее благоприятный. В этом случае больные не только возвращают утерянные навыки, но и приобретают новые.
Спинраза выпускается в дозировке 12 мг на 5 мл для интратекального введения (непосредственно в спинномозговую жидкость) и одобрен для всех возрастов и типов СМА без каких-либо ограничений. Существует разница между его введением в первый год применения и в дальнейшие. В первый год необходимо будет сделать 6 инъекций: 3 дозы с 14-ти дневным интервалом, 1 дозу спустя 35 дней и далее – раз в 4 месяца. Впоследствии препарат нужно будет применять постоянно в течение всей жизни каждые 4 месяца.
Препарат разработан компанией Biogen
Результаты клинических испытаний Спинразы (Nusinersen)
Компания Биоген представила новые данные по эффективности и безопасности применения Нусинерсен (Спинраза) у пресимптоматических пациентов со спинальной мышечной атрофией (СМА). Представленный анализ среза данных на февраль 2020 года и охватывает более 4,5 лет наблюдения, включая дополнительные 11 месяцев наблюдения в предыдущим обнародованным результатам.
Дополнительные результаты из промежуточного анализа на февраль 2020 года:
- Все участники исследования, кто ранее научился ходить с поддержкой (92%) и ходить самостоятельно (88%) сохранили эту возможность в течение более чем 11 месяцев с момента последнего среза данных, предшествующего текущему.
- В течении этого, более чем 11 месяцев дополнительного наблюдения, 1 ребенок достиг возможности ходить с поддержкой (повысив процент до 96% во всей группе участников) и также достиг максимальной оценки по шкале CHOP-INTEND, повысив общее количество участников исследования, кто достиг максимальной оценки по этой шкале до 21 из 25 (84%).
- Пациенты с 2 копиями гена SMN2 также показали возможность оценки их двигательных функций по шкале Хаммерсмит (Hammersmith Functional Motor Scale Expanded scale (HFMSE), что нетипично для пациентов с этой формой не получающих лечение.
Подробнее о результатах исследований можно прочитать по ссылке.
Ранее эффективность Спинразы была продемонстрирована в двойном слепом плацебо-контролируемом клиническом исследовании на пациентах младенческого возраста со СМА с клиническими проявлениями. Эффективность Спинразы также подтвердили открытые клинические исследования на группах пациентов со СМА до клинических симптомов, а также с клиническими проявлениями.
Промежуточный анализ показал улучшение двигательных навыков у большей доли пациентов, получавших препарат, чем среди получавших плацебо.
Некоторые пациенты приобрели двигательные навыки, такие как способность сидеть без поддержки, стоять или ходить при том, что без лечения это было маловероятно, а также остались в живых и достигли возраста, достижение которого было маловероятно.
Более подробно с результатами испытаний можно познакомиться здесь,здесь , в инструкции к препарату.
Инструкция к препарату Спинраза (Nusinersen)
Инструкция к препарату Спинраза (Нусинерсен).
3 июня 2025 года были внесены изменения в российскую инструкцию препарата нусинерсен. Согласно новой инструкции увеличен срок хранения препарата, который теперь составляет 5 лет вместо четырех, а также скорректирована информация о возможных побочных действиях препарата — в список нежелательных явлений добавлен арахноидит.
Клинические исследования препарата
Исследование Devote
Исследование направлено на дальнейшее развитие долгосрочного профиля безопасности и эффективности Нусинерсена при предполагаемом участии более 100 пациентов всех возрастов, включая взрослых пациентов. Оно будет изучать потенциал повышения эффективности, а также безопасности и переносимости при введении более высокой дозы. DEVOTE будет рандомизированным исследованием 2 и 3 фазы, с контролируемым повышением дозы, проводимым в 50 центрах по всему миру.
Исследование будет состоять из трех частей, которые будут включать в себя:
- Открытую оценку безопасности
- Основной двойной слепой рандомизированный период лечения с активным контролем
- Последующий открытый период лечения
По состоянию на апрель 2020 года в исследовании появился первый участник. Подробности исследования можно прочитать по ссылке.
Исследование Респонд
21 июля 2020 года компания Биоген, производитель лекарственного препарата нусинерсен (Спинраза) анонсировала новое клиническое исследование, которое планирует проводить уже с начала следующего года. В исследовании с названием РЕСПОНД планируется изучать комбинаторный эффект от применения препаратов Спинраза и Золгенсма.
Исследование РЕСПОНД задумано с целью оценить клинические преимущества и безопасность нусинерсена у детей со СМА после применения генной терапии онасемноген абепарвовек. В исследование планируется включить 60 детей в возрасте до 3 лет, которые ранее получили инфузию Золгенсма и которые, по мнению исследователя, могут иметь потенциально лучшие клинические результаты от последующего добавочного лечения нусинерсен.
Основная группа исследования будет включать 40 младенцев возрастом до 9 месяцев и младше (на момент первой дозы нусинерсен), с 2 копиями гена SMN2 (т.е. наиболее вероятно со СМА1 типа) и получили ранее генную терапию онасемноген абепарвовек в возрасте 6 месяцев и младше. Вторая группа исследования будет включать 20 детей более широкого возрастного диапазона (до 3 лет на момент первой дозы нусинерсен). После скринингового периода пациенты получать одобренную 12мг дозу нусинерсен, а после того как все 4 загрузочные дозы будут введены, будет получать лечение нусинерсеном каждый 4 месяца в течение 2-летнего периода исследования.
Исследование РЕСПОНД – открытое (open label) исследование 4 фазы, т.е. все пациенты будут получать препарат и обе стороны – и пациент и его врач будут знать, что они получают нусинерсен.
Регистрация Спинразы (Nusinersen) в разных странах мира
23 декабря 2016 года препарат был одобрен в США Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA)
21 июня 2017 года Европейское медицинское агентство (ЕМА) одобрило первый препарат для лечения спинальной мышечной атрофии (СМА) для применения в Европе.
По состоянию на июнь 2020 года 29 европейских стран имеет доступ к Нусинерсену на регулярной основе путём возмещения стоимости препарата.
Статус Спинраза (Nusinersen) в России
13 февраля 2019 года Спинраза получила в России орфанный статус. 16 августа 2019 года препарат был официально зарегистрирован в России.
В апреле 2020 года подана заявка о включении Нусинерсена (Спинразы) в перечень жизненно необходимых и важнейших лекарственных препаратов.
В августе 2020 года Минздрав РФ включил Спинразу(Нусинерсен) в клинические рекомендации по лечению СМА для детей с этим диагнозом.
23 ноября 2020 года препарат Спинраза (Нусинерсен) включен в перечень ЖНВЛП. Соответствующее распоряжение подписано Правительством РФ 23 ноября 2020 за номером 3073-р
Программы доступа к Спинразе (Nusinersen)
23 апреля 2019 года открылась программа расширенного доступа к первому и на сегодняшний день единственному препарату лечения СМА Спинразе. Программа будет распространяться на 40 младенцев со СМА 1-го типа
Обновленная информация о статусе доступа к Нусинерсен в странах Европы
Данный материал носит исключительно информационный характер и не может служить рекламой. Рекомендации относительно индивидуального применения этого лекарства следует получать у вашего лечащего врача.
Другие статьи о препарате Спинраза
Применение Нусинерсен (Спинраза) у взрослых пациентов со СМА
Полученные данные позволяют говорить о том, что лечение взрослых больных со СМА с помощью нусинерсен позволяет достичь значимых клинически улучшений двигательной функции или стабилизации состояния взрослых больных СМА. При этом, не выявлено зависимости и взаимосвязи возраста пациентов и эффективности терапии.

Новые данные эффективности Нусинерсен (Спинраза) у пресимтоматических больных со СМА
Компания Биоген представила новые данные по эффективности и безопасности применения Нусинерсен (Спинраза) у пресимптоматических пациентов со спинальной мышечной атрофией (СМА). Представленный анализ среза данных на февраль 2020 года и охватывает более 4,5 лет наблюдения, включая дополнительные 11 месяцев наблюдения в предыдущим обнародованным результатам.

Обновленная информация о статусе доступа к Нусинерсен в странах Европы
Компания Биоген – производитель лекарственного препарата нусинерсен (Спинраза) для патогенетического лечения больных спинальной мышечной атрофией представила обновление по статусу доступа к лекарственному препарату в странах Европы и Канады.
Последние публикации о лекарствах и клинических испытаниях

Данные 6-12 месячного наблюдения пациентов в исследовании STRONG интратекального применения AVXS-101
Исследование СТРОНГ стартовало в конце декабря 2017 года. Оно было остановлено FDA в 2019 году после сообщения о находках в параллельных преклинических исследованиях, которые могли потенциально влиять на безопасность применения. После долгих проверок данных это ограничение было снято во второй половине 2021 года, однако прерванный набор в исследование СТРОНГ не возобновился. После снятия ограничений на проведение исследований AVXS-101 IТ (интратекального ввода) были запущены другие, новые программы клинических исследований IT-версии препарата.
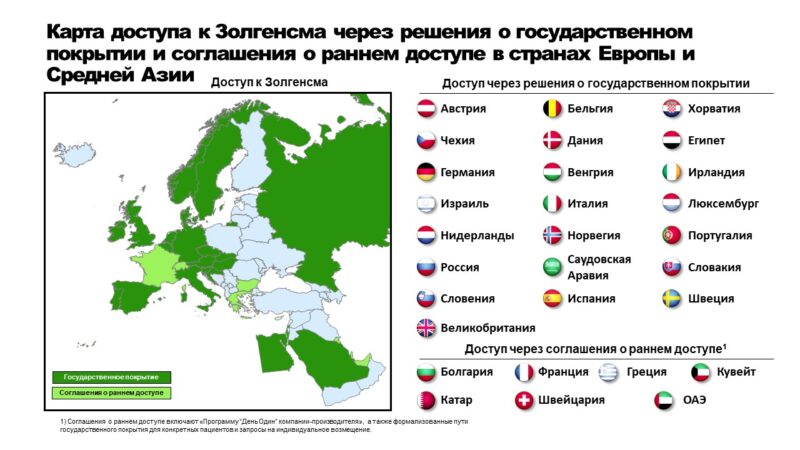
Доступ к Золгенсма в странах Европы и Средней Азии
В России препарат был одобрен в декабре 2021 года и оплачивается за счет средств федерального бюджета в рамках государственного фонда «Круг Добра».
Хирургия позвоночника эффективна у детей со СМА 1 типа, но не лишена рисков
Операция по исправлению кифосколиоза — сочетания двух типов аномального искривления позвоночника — позволяет успешно ввести Спинразу (нусинерсен) в позвоночный канал у детей со спинальной мышечной атрофией (СМА) 1 типа, как показывает исследование серии случаев.

Инструкция к препарату Онасемноген абепарвовек (Золгенсма)
Золгенсма (onasemnogene abeparvovec) — препарат генной терапии, разработанный для лечения больных проксимальной спинальной мышечной атрофией, вызванной нарушением в гене SMN1.

Инструкция к препарату Рисдиплам (Эврисди)
Рисдиплам (Эврисди) – препарат для лечения СМА, разработанный компанией Roche в сотрудничестве с PTC Therapeutics и SMA Foundation. Рисдиплам является модификатором сплайсинга (генетической модификации) гена SMN2, увеличивающим экспрессию полноразмерных функциональных белков.

Общеевропейское исследование пациентов со СМА — EUPESMA – Ожидания в отношении питания, физической терапии и лечения
Международная Ассоциация SMA Europe запустила общеевропейское исследование по питанию, физической терапии и ожиданиям от лечения и мы хотим пригласить вас стать его участником.

