Врачи постоянно ищут лекарства от спинальной мышечной атрофии.
Одни исследования оказываются более быстрыми и удачными. Другие -нет.
В этом разделе вы найдете новости о тех препаратах, разработка которых либо приостановлена, либо завершена, либо ведется не очень активно, поэтому сложно назвать конкретные сроки его появления и доступности для пациентов.
Другие статьи об исследуемых препаратах

Информация о клинической разработке RG7800
В ноябре 2014 года Рош начал стадию исследования «Moonfish» (фаза 1b/2a), основанные на благоприятных результатах испытаний, проведенных на здоровых добровольцах и токсикологических исследований на животных в течение 13 недель. Основная цель этого исследования — проследить безопасность применения и переносимость RG7800, а также измерить концентрации препарата в организме с течением времени (фармакокинетика) и влияние на сплайсинг гена SMN2 mRNAи производство белка SMN.

Genentech\PTC сообщает о приостановке клинической разработки препарата RG7800 для терапии СМА
«Как мы уже говорили ранее в этом году, неожиданно замеченное влияние на глаза наблюдается в исследованиях оценки долгосрочной безопасности RG7800 на животных. В качестве мер предосторожности, Genentech (Рош) приостановил фазу испытаний Moonfish в апреле 2015 года.
Положительные результаты клинической фазы испытаний ISIS-SMNRx на младенцах со СМА 1 типа
Исследование продемонстрировало, что мышечная и моторная функции у детей, получивших препарат ISIS-SMNRx, усилилась. Результаты также свидетельствовали о том, что препарат продолжает хорошо переносится и, по-видимому, имеет положительный эффект в отношении прогрессирования заболевания.
Последние публикации о лекарствах и клинических испытаниях

Рисдиплам вошел в перечень жизненно необходимых и важнейших лекарственных препаратов
Второй лекарственный препарат для лечения спинальной мышечной атрофии(СМА) , рисдиплам, включен в перечень ЖНВЛП (жизненно необходимых и важнейших лекарственных препаратов) с 2022 года. Соответствующее распоряжение подписано Правительством РФ 23 декабря 2021 за номером 3781-р .
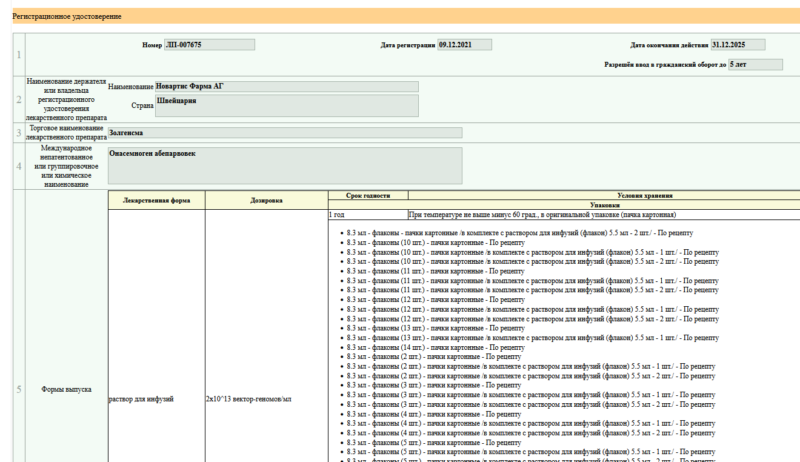
В России зарегистрирован препарат генной терапии для лечения СМА
9 декабря 2021 года в России был зарегистрирован и одобрен для применения первый препарат генной терапии и третий препарат для патогенетического лечения спинальной мышечной атрофии (СМА) — онасемноген абепарвовек (Золгенсма). Информация об этом была добавлена в Государственный реестр лекарственных средств (регистрационный номер ЛП-007675).

Новое клиническое исследование ASCEND применения повышенных дозировок нусинерсен после рисдиплама в лечении СМА
Компания Biogen сообщила о планах запуска нового международного клинического исследования ASCEND. Это исследование установит будет ли лечение исследуемой более высокой дозой нусинерсена иметь потенциал для улучшения клинических исходов и удовлетворения неудовлетворенных медицинских потребностей у пациентов со СМА, ранее получавших рисдиплам.

Программа управляемого доступа к Золгенсма закрыта для России
Компания Новартис сообщила о закрытии программы для пациентов из России, об этом компания сообщила в официальном письме фонду «Семьи СМА».
Одним из основных правил аллокации пациентов для участия в «розыгрыше» было условие, что на территории страны проживания пациента лечение препаратом AVXS-101 не возмещается за счет бюджетных средств или препарат не зарегистрирован.

В России стартовал набор в клиническое исследование DEVOTE повышенных дозировок нусинерсен при СМА
Цель нового исследования — изучить потенциал повышения эффективности препарата, а также безопасности и переносимости при введении более высокой дозы на широкой группе пациентов разных возрастов.

Новартис прекратил разработку препарата бранаплам для лечения спинальной мышечной атрофии
Компания Новартис приняла решение прекратить разработку бранаплам, экспериментального перорального модулятора сплайсинга РНК со способом применения раз в неделю для лечения спинальной мышечной атрофии (СМА) и завершении всех идущих, в том числе в России, клинических исследований этого препарата.