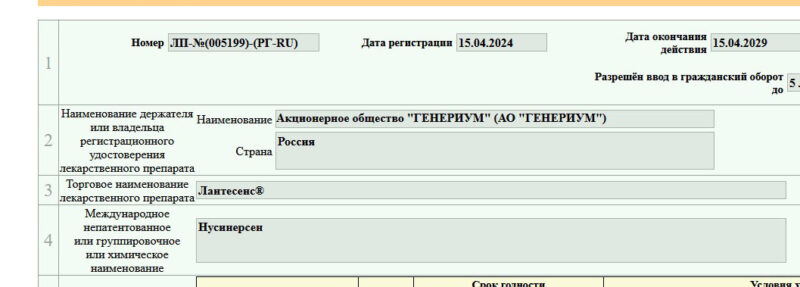
Biogen подал досье в FDA и EMA для одобрения применения высоких дозировок нусинерсена для лечения СМА
В конце января 2025 года компания Biogen сообщила о подаче заявок для одобрение режима повышенных дозировок нусинерсена для лечения СМА в американский (FDA) и европейский (EMA) регулирующие органы.