
Статья создана на основе вебинара «Планирование беременности в семьях СМА», который провела врач-генетик Елизавета Мусатова. На этом вебинаре рассказывается о планировании беременности в семьях, где уже есть ребенок или взрослый со спинальной мышечной атрофией (СМА), а также о разных видах тестирования на самые распространенные генетические заболевания.
Почему ребенок может родиться со СМА
Спинальная мышечная атрофия — это генетическое заболевание, при котором поражаются двигательные (моторные) нейроны передних рогов спинного мозга. Оно передается по наследству по аутосомно-рецессивному типу.
Аутосомами называются парные хромосомы, которые есть и у мужчин, и у женщин. Аутосомы – это не половые хромосомы.
Рецессивное заболевание означает, что человек должен унаследовать две измененные копии одного и того же гена (по одной измененной копии от каждого из родителей), и только в этом случае человек будет болен. Если человек получает только одну измененную копию гена (только от папы или только от мамы), он становится здоровым носителем измененного гена, и может передать болезнь своим детям только в случае, если партнер также окажется здоровым носителем. Сами родители при этом болеть не будут.
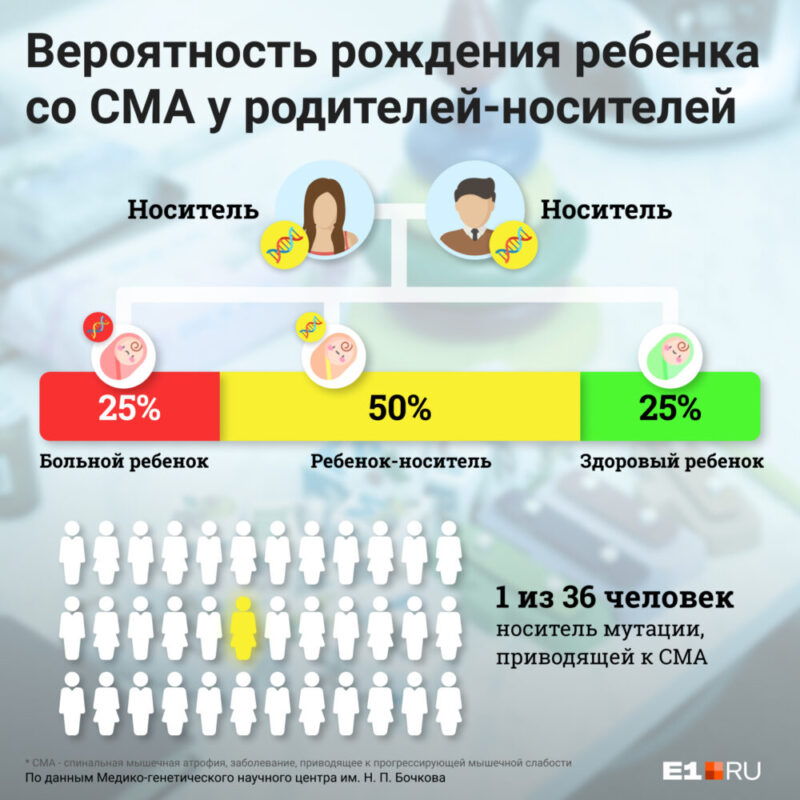
В результате, если в семье два родителя являются носителями измененного гена, приводящего к СМА, то существует 50 % вероятность того, что их ребенок будет здоровым носителем измененного гена, в 25 % случаях будет здоровым и не будет носителем измененного гена, и в 25 % случаев родится с генетическим заболеванием (СМА).
При этом носителем СМА среди европейцев является каждый тридцатый (при этом существуют данные о частоте носительства 1 к 40, 1 к 50)
Вероятность встречи двух носителей измененного гена статистически достаточно высока, и поэтому спинальная мышечная атрофия — одно из самых частых заболеваний с рецессивным типом наследования.
Как часто в мире рождаются дети со СМА?
Частота заболевания спинальной мышечной атрофией оценивается от 1 на 6000 до 1 на 10000 новорожденных. (Некоторые исследователи говорят о соотношении 1 на 5000). 50 % детей со СМА умирают в течение первых двух лет жизни.
Причиной болезни становится повреждение в гене SMN1. Этот ген кодирует белок выживаемости двигательных нейронов. При поломке гена не происходит синтез белка, важного для выживаемости двигательных нейронов, и в итоге мы наблюдаем повреждение нервных клеток, отвечающих за движение у пациента со СМА.
СМА с одинаковой вероятностью могут болеть и мальчики, и девочки.
При этом оба родителя – носители поломанной копии гена здоровы. Это означает, что до появления в семье больного ребенка, ни мама, ни папа не подозревают о возможной опасности рождения малыша со СМА. При этом в 50 % случаев и сами дети будут носителями генетической поломки без признаков болезни.
Как проявляется риск рождения ребенка со СМА?
Во время каждой беременности риск рождения ребенка со СМА в такой паре составляет 25 %. С вероятностью в 50 % младенец будет здоровым носителем измененного гена, еще в 25 % случаев ребенок может родиться здоровым и не является носителем измененного гена SMN1.
Все риски сохраняются с той же самой вероятностью для каждой последующей беременности в данной паре.
Иными словами, рождение ребенка со СМА не снижает и не повышает вероятность рождения второго малыша с таким же диагнозом. Есть 25% вероятности, что каждый последующий ребенок может родиться со СМА.
Если в семье один из супругов болен СМА, а у его партнера нет поврежденной копии гена SMN1,то в такой семье риск рождения больного ребенка не превышен, но все дети будут здоровыми носителями поломанного гена.
Если человек болен СМА, значит ли это, что его ребенок тоже будет болен СМА?
Это будет зависеть от генетического статуса супруга/и. Если супруг не является носителем мутации в гене SMN1 – ребенок будет 100% здоровым носителем.
Если супруг тоже носитель мутации, то в 50% (если ребенок получит две копии дефектного гена) он будет болен СМА, или же останется носителем (если от второго родителя получит немодифицированную копию гена).

Как планировать беременность в семьях, где есть носители измененного гена, приводящего к СМА или другим заболеваниям?
При планировании беременности вашему врачу очень важно знать семейную историю СМА, как и любого другого генетического заболевания.
Если в роду не было людей с генетическими заболеваниями, это не исключает скрытое носительство рецессивной патологии. Узнать о собственном носительстве измененных генов без специальных тестов невозможно. Ведь носители рецессивной патологии являются, как правило, здоровыми. Результаты любого генетического тестирования должен интерпретировать врач-генетик. Поэтому если к моменту первичной консультации у вас уже есть результаты генетических исследований, обязательно сообщите о них врачу.
Если у будущих родителей нет ни семейной истории, ни результатов корректно проведенных и расшифрованных генетических анализов, точно сказать, насколько высок риск появления в семье ребенка, например, со СМА нельзя. Он может быть и высоким, и низким. В любом случае при планировании беременности нужна консультация врача-генетика, на которой можно задать вопрос: «Насколько в нашем случае высок риск рождения ребенка со СМА или другим заболеванием?»
Зачем врачу-генетику нужна семейная история будущих родителей?
Для каждого из будущих родителей очень важно знать, были в их семье заболевания, которые гипотетически могут передаваться по наследству.
Если у кого-то из родственников будущих родителей или у них самих есть наследственное заболевание или подозрение на него, то знание этого дает возможность супругам вовремя пройти обследование. Это поможет правильно оценить риски и заранее вместе с врачом выбрать тактику их снижения.
У большинства людей, впервые приходящих на консультацию к врачу-генетику, такой семейной истории нет, и это совершенно нормальная ситуация, которая при этом не означает, что риски рождения больного ребенка в семье низкие.
Что делать, если у будущих родителей нет семейной истории по СМА и другим заболеваниям?
Бессимптомное, никем не замеченное носительство рецессивного заболевания может передаваться от поколения к поколению, пока два носителя мутаций в одном и том же гене не образуют пару. После такого совпадения в семье и вырастает риск рождения ребенка с рецессивным заболеванием. Таким образом, здоровые носители мутаций рецессивных заболеваний, могут не иметь больных родственников. Исключение составляют близкородственные браки, в которых может быть многолетняя история наследования в роду генетической патологии.
Какие обследования стоит пройти до наступления беременности?
Существует достаточно большое число распространенных генетических заболеваний, например, СМА или муковисцидоз. Каждый из нас является бессимптомным носителем определенного количества мутаций в разных генах – это нормально. Какие-то гены, ассоциированы с более частой наследственной патологией, какие-то – с более редкой. Главное, чтобы мутации у мужа и жены не случились в одних и тех же генах. Чтобы понять, так ли это, необходимо генетическое тестирование обоих супругов перед планированием ребенка.
Зачем нужен преконцепционный скрининг?
Преконцепционный скрининг – это тестирование на носительство рецессивных мутаций у здоровых супругов до зачатия ребенка. Лучше проходить его обоим партнерам одновременно до наступления беременности. Если пара заранее знает о своих генетических рисках, она сможет лучше спланировать и способ зачатия ребенка (естественный или с помощью ЭКО), ход беременности, необходимость дополнительного обследования развивающегося плода и своих действий в зависимости от результатов проведенных исследований.
Этический выбор родителей: ЭКО или естественное зачатие (беременность)?
Зная о высоком риске определенного генетического заболевания до момента зачатия, семья может поменять свои планы по способу достижения беременности. Например, выбрать процедуру ЭКО, при которой женщине переносят только здоровые эмбрионы, или по религиозным или иным убеждениям выбрать естественный путь для зачатия.
Пары, прошедшие преконцепционный генетический скрининг (об этом говорится в зарубежной статье 2018 года), в 60% случаях меняли свою репродуктивную тактику. 29% на момент опроса оставляли все, как есть, и 9 процентов не имели готового решения в момент исследования.
Смена тактики заключалась в проведении преимплантационного генетического тестирования (ПГТ-М) или инвазивной пренатальной диагностики. В большинстве случаев инициатором проведения преконцепционного скрининга был врач, что вновь подтверждает важность консультации у генетика при планировании беременности.
Какой объем скрининга на генетические заболевания нужен при планировании беременности?
Очевидно, что объем исследования может быть очень разный. Все зависит от решения и возможностей семейной пары.
Можно начать с тестирования на два самых распространенных заболевания для европейской популяции – СМА и муковисцидоз. Этот выбор оправдан в условиях ограниченногобюджета, пара защищает своего будущего ребенка от двух самых частых болезней с рецессивным типом наследования.
Или же можно выбирать более расширенные тесты (у каждой лаборатории — свой набор), важно помнить, что генов, отвечающих за рецессивные заболевания, очень много, так что, кроме двух самых распространенных заболеваний, есть еще варианты тестирования.
Какой бы конкретный преконцепционный тест пара ни выбрала, нельзя сказать, что это правильное или ошибочное решение. Ни один врач заранее не может знать, в каких именно генах супруги имеют мутации, и есть ли совпадения. Поэтому неверно будет сказать пациенту: «Давайте сделаем проверку вот по этому списку генов или мутаций, и тогда всё будет замечательно». Если бы было заранее известно, в каких генах мутации есть у супругов, то при преконцепционном скрининге с ограниченным перечнем проверяемых генов можно было бы снизить риски. Но такой информации ни врач, ни семья не имеют.
Так, например, можно сделать секвенирование экзома для определения мутаций в ДНК, которые являются причиной огромного количества рецессивных болезней. Этоттест стоит дороже, чем тесты, включающиеся в себя единичные гены, а его результаты можно получить за 35 рабочих дней. Он позволяет в образце крови пациента за один раз посмотреть значимые повреждения в генах.
У теста есть ряд технических ограничений. С помощью него одного нельзя проверить, например, мутации в гене SMN1 – причину спинальной мышечной атрофии или одну из мутаций в гене CFTR – частую причину муковисцидоза. В лаборатории Генетико есть комплексная услуга, которая помимо секвенирования экзома включает в себя ряд дополнительных тестов, очень полезных при планировании беременности, в том числе тест на носительство СМА, а также тест на носительство премутации в гене FMR1 для будущей мамы (причина синдрома Мартина-Белл, при котором наблюдается интеллектуальный дефицит).
Обследование на носительство у будущих родителей может быть разного объема. Детали и варианты лучше уточнить на консультации у врача-генетика.
Результаты любых генетических тестов должны интерпретироваться врачом-генетиком. После оценки результатов доктор может дать заключение относительно риска рождения ребенка с рецессивным заболеванием у конкретной пары. Если риск низкий, то во время беременности проводится стандартный объем обследований.
Комбинированный скрининг первого триместра – после наступления 11 недели беременности и не позднее 13 недель и 6 дней проводится анализ образца венозной крови беременной женщины и УЗИ плода для оценки риска самых частых хромосомных синдромов, например, синдрома Дауна.
Неинвазивное пренатальное тестирование (НИПТ) – еще один вид скрининга на риски самых частых хромосомных синдромов по более точной технологии. НИПТ можно сдавать на любом желаемом сроке беременности после наступления 10 полных акушерских недель.
Если врач-генетик после консультации определил риск генетических заболеваний у будущего ребенка как низкий, это не означает, что риск равен нулю. Если во время беременности у докторов возникают подозрения на возможную патологию плода, возможны дополнительные обследования при наличии показаний.
Что делать при высоком риске генетических заболеваний?
Что же делать при выявлении высокого риска рождения ребенка с наследственным заболеванием? Врач-генетик на консультации обязательно обсудит несколько вариантов действий. Семья имеет возможность выбора того пути снижения рисков, который считает для себя приемлемым. Теоретически пара может решить ничего не делать с выявленным высоким риском. Это крайне рискованное решение, тем более, что на сегодняшний момент существует несколько способов рождения в семье здорового ребенка.
Использование донорских половых клеток для зачатия ребенка
Пара может использовать донорские половые клетки: яйцеклетки или сперматозоиды. Разумеется, этот вариант подходит далеко не каждому, потому что один из родителей не будет биологическим для ребенка.Существуют варианты, когда высокий генетический риск у будущего ребенка можно снизить, не прибегая к помощи донорского материала, а используя собственные половые клетки. Поэтому использование половых клеток донора, как правило, не является популярным решением.
Инвазивная пренатальная диагностика
Инвазивная пренатальная диагностика – это исследование, направленное на тестирование искомой мутации у развивающегося плода. Она проводится после 10-11 недели беременности с целью выявления тех генетических заболеваний, высокий риск которых в семье был определен ранее.
У этого точного метода есть один недостаток. Он проводится после наступления беременности, плод уже развивается, и при обнаружении генетического заболевания на этом этапе пара должна решить, продолжать беременность или прервать ее.
Это трудный выбор для родителей.
Преимплантационное генетическое тестирование (ПГТ)
Это исследование эмбрионов на этапе до их переноса в организм мамы. Для проведения ПГТ требуется получение эмбрионов при искусственном зачатии, в протоколе ЭКО. Основное преимущество ПГТ состоит в том, что тестирование проводится до момента наступления беременности. Соответственно, родители выбирают эмбрион на перенос с учетом заранее определенного генетического статуса.
В протоколе ЭКО врачом-репродуктологом проводится гормональная стимуляция, в процессе которой в организме женщины созревает несколько яйцеклеток. В определенный момент их забирают из организма женщины и оплодотворяют спермой мужа.
На пятый-шестой день развития эмбрион достигает стадии бластоцисты: у эмбриона есть наружная клеточная оболочка и внутренняя клеточная масса. Для ПГТ берут несколько клеток из наружной клеточной оболочки, и проводится генетическое тестирование. Внутренняя клеточная масса при проведении биопсии не используется, так как из этой части бластоцисты в будущем развивается само тело эмбриона, поэтому бояться пороков развития плода вследствие биопсии не стоит.
Далее в генетической лаборатории анализируются клетки каждого эмбриона на носительство мутаций, приводящих к имеющемуся в семье генетическому заболеванию. После этого семья может выбрать для переноса из исследованных эмбрионов либо здоровых, либо носителей заболевания. Это позволяет предотвратить появление больного малыша в семье.
Два вида преимплантационного генетического тестирования: на моногенное заболевание и на хромосомную аномалию
Для повышения вероятности рождения здорового ребенка при высоком риске моногенного заболевания лучше проводить ПГТ в два этапа: сперва изучаем все эмбрионы на моногенное заболевание, а затем эмбрионы без мутации можно дополнительно проверить на хромосомные аномалии.
Такая тактика позволит повысить частоту наступления беременности и ее благополучного протекания, поскольку некоторые хромосомные аномалии препятствуют успешному началу беременности и увеличивают возможность неразвивающейся беременности.
Средний возраст пациенток, которые делают ПГТ на моногенные заболевания в лаборатории Генетико 35 лет.
В Генетико проанализировано более 35000 эмбрионов при выполнении различных видов ПГТ. Важно помнить, что после проведения ПГТ на моногенное заболевание, семье рекомендовано пройти инвазивную пренатальную диагностику для подтверждения результатов ПГТ. При высоком риске рождения ребенка с определенным генетическим заболеванием и проведении ПГТ, рекомендовано пройти подтверждающее генетическое тестирование и новорожденному.
Почему важен и в чем заключается предварительный этап преимплантационного генетического тестирования на моногенное заболевание?
Представим себе ситуацию, что в семье уже есть один ребенок со спинальной мышечной атрофией или другим генетическим заболеванием. Заранее известно, что оба родителя являются носителями поврежденных копий гена. Означает ли это, что можно приступать непосредственно к анализу эмбрионов и более ничего не требуется?
Нет. Для достижения максимальной точности ПГТ на моногенное заболевание необходим, так называемый, подготовительный этап, как правило, включающий в себя анализ ДНК родителей и других членов семьи. Чтобы определить, что именно необходимо для подготовительного этапа, врач должен познакомиться с историей заболевания в семье, учесть тип наследования, узнать, кто из родственников доступен для предоставления образцов ДНК. Все это нужно обсуждать на консультации с врачом-генетиком.
Качественно проведенный подготовительный этап при ПГТ на моногенное заболевание позволит осуществить проверку эмбрионов с высокой точностью.
Современная клиническая практика такова, что семьи чаще всего узнают о высоком риске генетического заболевания уже после рождения больного ребенка. По статистике Генетико из 20 семей, которые сделали ПГТ на СМА, у 19 уже был ребенок с этим заболеванием.
Генетические исследования целесообразно проводить до появления в семье ребенка с наследственными заболеваниями. Это позволит парам управлять своими генетическими рисками.
Благодарим Елизавету Валерьевну Мусатову за медицинскую редактуру статьи.
Данный материал носит исключительно информационный характер и не может служить рекламой. Рекомендации относительно индивидуального применения любого лекарственного препарата или назначения лечения следует получать у вашего лечащего врача.




