Компания Авексис представила промежуточные данные по продолжающемуся клиническому испытанию препарата AVXS-101 в фазе 1 на конгрессе Всемирного общества нервно-мышечных заболеваний в октябре 2016г.
Данные демонстрируют значительное улучшение состояния испытуемых со СМА 1 типа
Компания Авексис (AveXis), разрабатывающая и проводящая клинические испытания генной терапии для пациентов с редкими и смертельными неврологическими генетическими заболеваниями, представила обновленную информацию по промежуточным результатам первой фазы испытаний препарата AVXS-101 для лечения спинальной мышечной атрофии (СМА) 1 типа, по состоянию на 15 сентября 2016 г. Данные представил д-р Джерри Менделл, директор Центра генной терапии при Исследовательском институте Национальной детской больницы (США). Презентация прошла в рамках 21-го Международного ежегодного конгресса Всемирного общества нервно-мышечных заболеваний (World Muscle Society), который прошел в Гранаде, Испания. Ранее в этом году компания Авексис получила для препарата AVXS-101 статус «прорывного» от Управления по контролю пищевых продуктов и лекарственных средств США (FDA), и он стал первым препаратом для лечения СМА, получившим такой статус.
На презентации были впервые представлены промежуточные данные по клиническому исследованию, включая информацию о достижении пациентами ключевых моторных функций по состоянию на 15 сентября 2016г.
Две трети пациентов в когорте 2 достигли способности сидеть самостоятельно, в том числе один пациент, у которого достижение этой функции было подтверждено после 15 сентября. В когорте 2, 11 из 12 пациентов смогли удерживать голову, 7 из 12 пациентов смогли полностью переворачиваться, 11 из 12 пациентов смогли сидеть с поддержкой. Два пациента в настоящий момент могут самостоятельно ходить, в том числе один пациент, у которого достижение этой функции было подтверждено после 15 сентября. Эти два пациента также ранее освоили такие важные функции, как способность ползать, стоять с поддержкой, стоять без поддержки и ходить с поддержкой.
«На сегодняшний день большинство пациентов, получивших предлагаемую терапевтическую дозу препарата AVXS-101, достигли ключевых моторных функций, а две трети этих пациентов могут сидеть без поддержки. Данные достижения полностью выходят за рамки обычного течения СМА, поскольку дети со СМА 1 типа без лечения никогда не могут сидеть без поддержки», — заявил Шон Нолан, президент и генеральный директор компании Авексис, — «Промежуточные данные вдохновляют нас, и мы продолжаем усердно работать над тем, чтобы данная генная терапия стала доступной для детей, страдающих этим тяжелым заболеванием».
Промежуточные данные по Фазе 1, по состоянию на 15 сентября 2016 г.
· Согласно данным на 15 сентября 2016 г., препарат AVXS-101 продолжает демонстрировать благоприятный профиль безопасности и в целом хорошо переносится. Никаких оснований для беспокойства о безопасности или переносимости препарата выявлено не было.
На 15 сентября 2016 г. сообщалось о 118 нежелательных явлениях (НЯ), из них 34 были определены как серьезные нежелательные явления (СНЯ) и 84 – как несерьезные НЯ. Как сообщалось ранее, всего 5 НЯ у 4 пациентов были связаны с проводимой терапией. Два были квалифицированы как СНЯ, связанные с проводимой терапией (у двух пациентов) и три были квалифицированы как несерьезные Н
Я (у 3 пациентов). Все они представляли собой бессимптомное повышение уровня ферментов печени.
Все НЯ и СНЯ, связанные с повышением уровня ферментов печени, не имели клинических симптомов и пришли в норму после курса лечения преднизолоном. Не наблюдалось клинически значимых повышений уровня гамма-глутамилтрансферазы
(ГГТ), щелочной фосфатазы или билирубина. Таким образом, «закон Хая» (индикатор тяжелого лекарственного поражения печени) не был нарушен.
Прочие НЯ, не связанные с проводимой терапией, были ожидаемы и связаны со СМА.
· Ни у одного из пациентов в Когорте 2 (предлагаемая терапевтическая дозировка) не наступило «событие», под которым подразумевается смерть или необходимость в дыхательной поддержке длительностью 16 часов в день и более на протяжении двух недель и более в отсутствие острого обратимого заболевания или периоперационного периода. Средний возраст при последнем обследовании Когорты 2 составлял 17,3 мес. Возраст самого старшего пациента был 27,4 мес.
Как сообщалось ранее, у одного пациента в Когорте 1 (когорта с низкой дозировкой) произошло лёгочное «событие» после 1 июля 2016 г. Для пациента увеличили использование двухфазной вентиляции с положительным давлением в дыхательных путях (BiPAP) перед операцией, связанной с повышенным слюноотделением (эта патология наблюдается у некоторых пациентов со СМА). Независимо
е обследование установило, что данное «событие» — это признак прогрессирования заболевания, не связанный с использованием AVXS-101.
· Показатели CHOP-INTEND в среднем выросли на 9,0 баллов в Когорте 1 и на 24,8 баллов в Когорте 2, то есть двигательные функции пациентов улучшились (тест CHOP-INTEND был разработан для измерения двигательных навыков пациентов со СМА 1 типа).
11 из 12 пациентов в Когорте 2 получили 40 и более баллов по шкале CHOP-INTEND.
9 из 12 пациентов в Когорте 2 получили 50 и более баллов по шкале CHOP-INTEND.
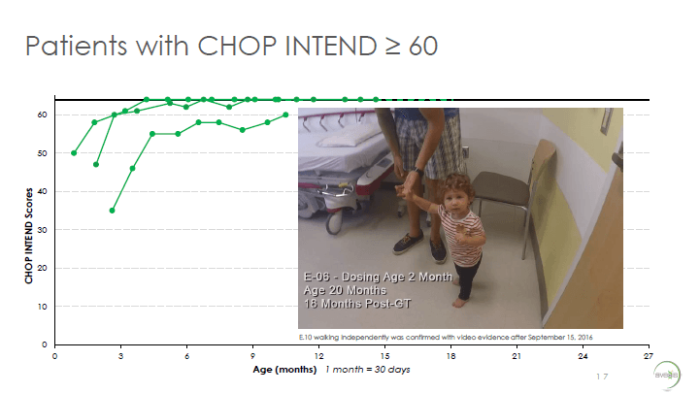
3 из 12 пациентов в Когорте 2 получили 60 и более баллов по шкале CHOP-INTEND, что соответствует развитию здорового ребенка.
Пациенты, получающие AVXS-101 в предлагаемой терапевтической дозировке, стабильно приобретали и удерживали ключевые двигательные навыки.
По состоянию на 15 сентября 2016 г., 11 из 12 пациентов могли удерживать голову; 7 из 12 пациентов могли переворачиваться (полностью); 11 из 12 пациентов могли сидеть с поддержкой; 8 из 12 пациентов могли сидеть без поддержки, включая одного пациента, у которого достижение этой функции было подтверждено после 15 сентября.
Кроме того, 7 пациентов могли есть самостоятельно, включая одного пациента, у которого достижение этой функции было подтверждено после 15 сентября.
5 пациентов могут говорить (1 из них двуязычен).
4 пациента в данный момент могут стоять с поддержкой, включая двух, у которых достижение этой функции было подтверждено после 15 сентября.
2 пациента в данный момент могут самостоятельно ходить, включая одного, у которого достижение этой функции было подтверждено после 15 сентября. Каждый из этих двух пациентов ранее освоил такие важные функции как ползание, стояние с поддержкой, самостоятельное стояние и ходьба с поддержкой.
«Предварительные клинические наблюдения, в которых зарегистрирована выживаемость без «событий», стабильное улучшение двигательных функций и достижение ключевых функций у пациентов, получивших однократную инфузию AVXS-101, значительно превосходят все то, что наблюдается при естественном течении заболевания», — заявил Суку Нагендран, доктор медицины, старший вице-президент и главный медицинский специалист компании Авексис, — «Эти предварительные результаты демонстрируют потенциальную способность препарата AVXS-101 положительно влиять на качество жизни и, таким образом, изменять течение заболевания у данных детей со СМА 1 типа».
Общая информация о препарате генной терапии:
Причиной спинальной мышечной атрофии (СМА) является мутация в гене выживаемости мотонейронов 1 (SMN1). Из-за данной мутации в организме не производится достаточное количество белка выживаемости мотонейронов (SMN).
Перенос генов может помочь увеличить уровень белка SMN, используя вирус, который называется «вектор», для доставки гена SMN1 в поврежденные клетки. Д-р Брайан Каспар и Д-р Менделл обнаружили, что аденоассоциированный вирус серотипа 9 (AAV9) обладает уникальной способностью преодолевать гематоэнцефалический и гемато-ликворный барьеры.
В настоящий момент изучаются два подхода: внутривенная инъекция, также известная как «системная доставка» (данный подход исследуется в настоящем клиническом испытании), и доставка напрямую в спинномозговую жидкость. Генная терапия с доставкой в спинномозговую жидкость имеет потенциальное преимущество, поскольку для более крупных и старших пациентов потребуется меньшее количество препарата. Это в конечном счете могло бы сделать лекарство более доступным для широких слоев населения.
Статья основана на переводе и адаптации материала Cure SMA:
За помощь с переводом благодарим Марию Никитину



