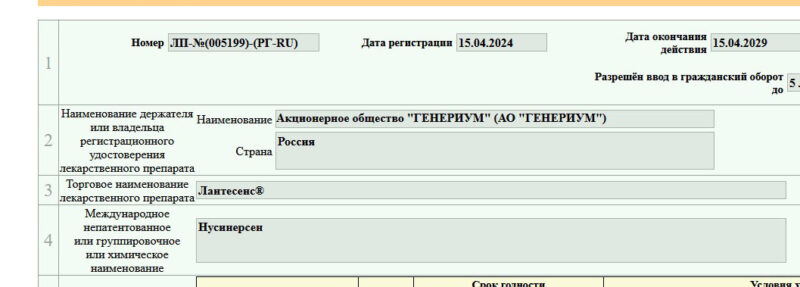
FDA не одобрило применение нусинерсена в более высокой дозировке
(FDA) отложило одобрение дополнительной заявки на регистрацию лекарственного препарата (sNDA) для высокодозного режима применения нусинерсена (Спинраза) для пациентов со спинальной мышечной атрофией (СМА).