В 2018 году компания Сytokineticsinc.gcs-web.com заявила о результатах испытаний препарата, который потенциально может стать средством лечения для людей со СМА.
Релдесемтив — активатор тропонина быстрых мышц нового поколения, являющийся результатом программы Сайтокинетикс по изучению сокращательной способности скелетных мышц, замедляет высвобождение кальция из регулирующего тропонинового комплекса волокон быстрых скелетных мышц, что приводит к сенситизации саркомера к кальцию, что в свою очередь ведет к повышению сокращательной способности мышц.
Релдесемтив продемонстрировал фармакологическую активность, которая может привести к появлению новых терапевтических возможностей для заболеваний, связанных со слабостью или утомляемостью мышц.
В доклинических моделях СМА активатор скелетных мышц показал повышение субмаксимальной силы скелетных мышц в ответ на нейрональный сигнал и откладывание наступления и облегчение выраженности мышечной усталости. Препарат употребляется перорально (через рот). Более подробно о препарате можно прочитать здесь
Результаты клинических исследований
Результаты 2-й фазы клинических исследований релдесемтива у пациентов со спинальной мышечной атрофией (СМА), проведенных компанией Цитокинетикс, были представлены в 2018 году профессором Джоном В. Дэем (MD, PhD) в ходе презентации на ежегодной конференции Cure SMA в Далласе.
Это исследование, направленное на выдвижение гипотез, достигло и своей основной цели по определению потенциального фармакодинамического эффекта многократного перорального приема релдесемтива у пациентов со СМА, и вторичных целей по определению безопасности, переносимости и фармакокинетики исследуемого препарата.
Цитокинетикс разрабатывает релдесемтив в сотрудничестве с компанией Астеллас как потенциальное средство лечения людей со СМА, а также некоторых других инвалидизирующих заболеваний и состояний, связанных со слабостью и утомляемостью скелетных мышц.
Исследование показало дозо- и концентрато-зависимое увеличение продолжительности времени до утомления мышц через 8 недель после начала приема релдесемтива по сравнению с показателями в начале исследования, что измерялось с помощью 6-минутного двигательного теста (6MW – 6minute walking test), суб-максимального двигательного испытания аэробных возможностей и выносливости, и показателей максимального давления на выдохе (MEP), демонстрирующего силу дыхательных мышц.
В исследовании, в котором испытывались 2 дозы релдесемтива, по 150 и 450 мг 2 раза в день, было выявлено дозозависимое увеличение дистанции, пройденной в ходе 6-минутного двигательного теста у ходящих пациентов, которое измерялось на 2 временных интервалах после начала лечения, через 4 и 8 недель. В группе, принимавшей 150мг релдесемтива 2 раза в день, увеличение дистанции по сравнению с плацебо составило 10.86 метра (p=0.2531) через 4 недели лечения релдесемтивом и 7.72 метра (p=0.4684) через 8 недель лечения. В группе, получавшей 450 мг релдесемтива 2 раза в день, повышение составило 35.63 метра (p= 0.0037) через 4 и 24.89 метра (p= 0.0584) через 8 недель.
Кроме того, была выявлена статистически значимая корреляция между Cmax, или пиковой концентрацией релдесемтива, и повышением показателей 6-минутного двигательного теста с примерным соотношением 9.53 метров/(µg/mL) (p=0.0086).
Помимо этого, исследование показало улучшение показателей максимальной силы на выдохе по сравнению с плацебо. В группе, получавшей 150 мг 2 раза в день, увеличение этого показателя оказалось 5.95 см H2O (p=0.2276) через 4 недели лечения релдесемтивом и 11.69 см H2O (p=0.0378) через 8 недель лечения. В группе, получавшей 450 мг 2 раза в день, рост по сравнению с плацебо был 9.17 см H2O (p=0.0855) через 4 недели лечения релдесемтивом и 13.15 см H2O (p=0.0298) через 8 недель лечения.
Другие показатели, замеренные в ходе исследования, включая Функциональную моторную шкалу Хаммерсмита – Расширенную (HFMSE), Пересмотренный модуль верхних конечностей (RULM), измерение времени на вставание и форсированная жизненная емкость легких, не показали значимых отличий в группе принимающих релдесемтив и в группе принимающих плацебо.
Побочные эффекты
Побочные эффекты в группах релдесемтива и плацебо были одинаковыми. Наиболее часто наблюдаемыми побочными эффектами были головная боль, запор и тошнота. У четырех пациентов были отмечены серьезные побочные эффекты, которые привели ко временному прекращению участия в исследовании, но все они были оценены как не имеющие отношения к релдесемтиву
Данный материал носит исключительно информационный характер и не может служить рекламой. Рекомендации относительно индивидуального применения этого лекарства следует получать у вашего лечащего врача.
Другие статьи о препарате Релдесемтив

Компания Цитокинетикс объявила результаты клинических испытаний 2-й фазы препарата релдесемтив у пациентов со спинальной мышечной атрофией
Первое исследование мышечно-направленной терапии у пациентов со СМА показало потенциально клинически значимое влияние на дистанцию, пройденную в ходе 6-минутного теста и максимальное давление на выдохе.

Cytokinetics продолжает набор пациентов со СМА для 2-й фазы клинического исследования препарата CK-2127107
Компания Cytokinetics (Сайтокинетикс) продолжает набор во вторую группу пациентов для второй фазы клинического исследования препарата CK-2127107 в качестве лечения спинальной мышечной атрофии (СМА). Исследовательские центры расположены в США и Канаде.
Последние публикации о лекарствах и клинических испытаниях
Биоген представил первые результаты исследования DEVOTE применения повышенных дозировок нусинерсена для лечения СМА
На прошедшем 8-12 октября 2024 года в Праге Конгрессе World Muscle Society компания Биоген представила первые результаты части B и C исследования фазы 2/3 DEVOTE7., которое изучало применение более высокой дозы нусинерсена по сравнению с одобренной и применяющейся сейчас для лечения людей со СМА.

Рош представил результаты 2-летнего исследования RAINBOWFISH применения рисдиплама у пресимптоматических младенцев со СМА
Компания Рош представила новые данные своих исследований на 29-м ежегодном конгрессе World Muscle Society, прошедшего в Праге 8-12 октября 2024 года. На конгрессе были представлены

Представлены результаты долгосрочного приема рисдиплама у детей со СМА 1 типа в течение 5 лет
Компания Рош представила новые финальные данные 5-летнего наблюдения в рамках основного клинического исследования FIREFISH (NCT02913482). Данные были представлены на прошедшей в начале июня конференции Cure SMA Research & Clinical Care Meeting 2024 в Техасе (США).
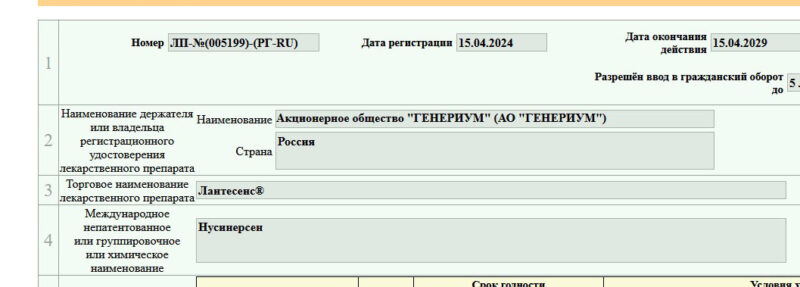
В России зарегистрирован еще один препарат для лечения спинальной мышечной атрофии
Минздрав зарегистрировал в России препарат Лантесенс — отечественный аналог Спинразы (международное непатентованное наименование – нусинерсен), применяемого для терапии всех типов спинальной мышечной атрофии у детей и взрослых.

Обновлены критерии участия в клиническом исследовании BLUEBELL препарата генной терапии ANB-004 российской компании BIOCAD
Данный материал носит исключительно информационный характер и не является рекламой. Рекомендации относительно индивидуального применения лекарственных препаратов следует получать у вашего лечащего врача.

Пероральная терапия NIDO-361 для спино-бульбарной мышечной атрофии успешно завершила 1 фазу клинических исследований
NIDO-361, экспериментальное пероральное средство от спино-бульбарной мышечной атрофии (СБМА или болезнь Кеннеди) компании Nido Biosciences, оказалось в целом безопасным и хорошо переносимым у здоровых взрослых, принявших участие в клиническом исследовании фазы 1(ACTRN12622000964718). Его результаты были представлены во время Международной конференции по болезни Кеннеди в ноябое 2023 года в Лондоне.




