Компания Roche представила последнюю информацию о 2 пероральных препаратах, находящихся на стадии разработки, олезоксиме и RG7916. А также сообщает о трех стадиях исследования RG7916, в которые в настоящее время идет набор пациентов – SUNFISH (типы 2 и 3), FIREFISH (тип 1) и JEWELFISH (пациенты с типов 2/3, уже получавшие лечение другими модификаторами сплайсинга).
Олезоксим
Олезоксим является веществом, назначаемым перорально для поддержания функции митохондрий и поддержки и продления функционирования клеток
Европейское Медицинское Агентство (ЕМА) и Американская Администрации по контролю лекарственных средств и продуктов питания (FDA) запросили дополнительные данные по соотношению преимуществ и рисков применения препарата в исследованиях фазы 3
Мы учли обратную связь ЕМА и FDAи планируем проведение дополнительно исследования олезоксима в фазе 3. Мы проинформируем вас о ходе подготовки в ближайшие месяцы
RG7916
RG7916 является модификатором сплайсинга SMN2, назначаемым перорально и распределяющимся по всему телу
Препарат находится в стадии клинических испытаний, проводимых совместно c компанией PTC Therapeuticsи SMA Foundation
RG7916 получил в FDAстатус препарата для лечения редких заболеваний (Orphan Drug Designation)
В какие клинические испытания RG7916 идет набор пациентов в настоящее время?
В настоящее время идет набор пациентов в 3 клинических испытания препарата RG7916: SUNFISH, FIREFISHи JEWELFISH
Для включения в любые испытания RG7916 потенциальные участники должны соответствовать всем критериям включения
SUNFISH
Задача: Оценить эффективность и безопасность использования RG7916 у пациентов со СМА типов 2 и 3
На этапе 1 будет оцениваться безопасность и переносимость 2 различных дозировок RG7916
На этапе 2 будет оцениваться эффективность и безопасность RG7916 в выбранной на этапе 1 дозировке
Кто может быть включен?Дети и молодые взрослые (2-25 лет) со СМА типов 2 и 3*
Дизайн исследования:исследование SUNFISHсостоит из 2 этапов
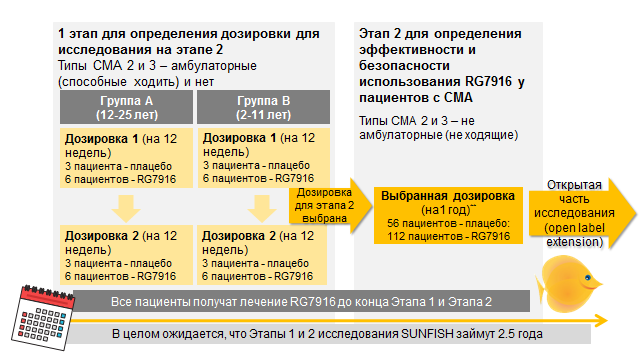
Текущий статус: Запланированный набор 10 взрослых и подростков (Группа А) и 9 детей (Группа В)*** на Этап 1 Дозировка 1 (низкая доза) исследования RG7916 завершен. Набор на Этап 1 Дозировка 2 (высокая доза) в настоящее время продолжается.
Оценка безопасности:Безопасность участников испытаний является нашим приоритетом. Как запланировано в протоколе исследования, Комитет мониторинга безопасности рассматривает всю информацию, имеющую отношение к безопасности, от всех участников исследования SUNFISH. После оценки информации о безопасности, полученной после применения низкой дозы, назначенной Группе В на Этапе 1, Комитет разрешил продолжить исследование в соответствии с планом
Дальнейшие шаги: начало Этапа 2 планируется на вторую половину 2017 года, на этом этапе будут включены дополнительные клиники и страны
* Потенциальные участники должны соответствовать всем критериям включения прежде чем быть допущенными к исследованию SUNFISH
** Доработанный протокол ожидает утверждения регулирующими органами
*** Может быть проведен дополнительный набор участников в Этап 1 Дозировку 1 Группу В
FIREFISH
Задача: Оценить эффективность и безопасность использования RG7916 у детей от 1 до 7 месяцев с СМА типа 1
На этапе 1 будет оцениваться эффективность и безопасность RG7916 в 2 различных дозировках
На этапе 2 будет оцениваться эффективность и безопасность RG7916 в выбранной на этапе 1 дозировке
Кто может быть включен? Дети от 1 до 7 месяцев с СМА типа 1*
Дизайн исследования: исследование SUNFISHсостоит из 2 этапов
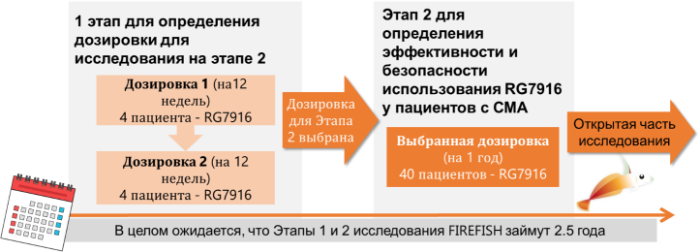
Текущий статус: Первый ребенок был включен в исследование в декабре 2016 года, исследование продолжается в Европе. Этап 1 исследования FIREFISHбудет начат в дополнительных странах и клиниках, включая США, в течение ближайших месяцев.
Оценка безопасности: Безопасность участников испытаний является нашим приоритетом. Как запланировано в протоколе исследования, Комитет мониторинга безопасности рассматривает всю информацию, имеющую отношение к безопасности, от всех участников исследования FIREFISH.
Дальнейшие шаги: начало Этапа 2 планируется на вторую половину 2017 года, на этом этапе будут включены дополнительные клиники и страны
*Потенциальные участники должны соответствовать всем критериям включения прежде чем быть допущенными к исследованию FIREFISH
JEWELFISH
Задача: Оценить безопасность и переносимость использования RG7916
Кто может быть включен? Пациенты с СМА, ранее получавшие терапию, направленную на SMN2 (либо в рамках исследования MOONFISHс RG7800, либо с другим препаратом, направленным на SMN2)

Текущий статус: Первый пациент получил первую дозу в клинике в США
Оценка безопасности: Безопасность участников испытаний является нашим приоритетом. Как запланировано в протоколе исследования, Комитет мониторинга безопасности рассматривает всю информацию, имеющую отношение к безопасности, от всех участников исследования JEWELFISH.
Дальнейшие шаги: запланировано продолжение скрининга и включения пациентов в клиниках США и Европы
*Потенциальные участники должны соответствовать всем критериям включения прежде чем быть допущенными к исследованию JEWELFISH
Как могу я или член моей семьи узнать, каким образом стать участником исследований SUNFISH, FIREFISH или JEWELFISH?
Пожалуйста, обратитесь к своему врачу или в пациентскую организацию, если Вы считаете, что Вы или член Вашей семьи мог бы стать участником одного из этих исследований
Вы можете также посетить сайт www.roche-sma-clinicaltrials.com, где имеется больше информации о нашей программе
Локальное объединение пациентов в месте Вашего проживания может иметь больше информации и ресурсов
Как мне получить больше информации?
Вы можете узнать больше об исследованиях SUNFISH, FIREFISHили JEWELFISHна сайте www.clinicaltrials.gov и www.clinicaltrialsregister.eu
Скачать Обращение компании
Перевод выполнен специально для фонда «Семьи СМА».
Благодарим за помощь с переводом Наталью Мефодовскую



