Усилиями команды ученых из Cold Spring Harbor Laboratory (CSHL) удалось пролить новый свет на патологию, вызывающую спинальную мышечную атрофии.
СМА — редкое, но крайне опасное заболевание, вызывающее мышечную слабость и паралич и являющееся основной причиной младенческой смертности. Новые подходы ученых, стремящихся найти оптимальные стратегии лечения пациентов, могут оказаться ценными.
СМА — это заболевание моторных нейронов, приводящее к дегенерации нервов, контролирующих мышцы и произвольные движения. Эти нейроны нуждаются в белке, известном как «протеин выживаемости мотонейронов» ( Survival of Motor Neuron; SMN). Обычно, в каждой клетке содержатся инструкции для синтеза двух его вариантов, обозначаемых SMN1 и SMN2. У здоровых людей SMN1 находится в изобилии, тогда как SMN2, по причуде молекулярного редактирования, продуцируется в основном в редуцированной, нестабильной форме.
У больных СМА, однако, инструкции для продуцирования SMN1 нарушены, так что клетки более не производят этот белок. Таким образом, клетки вынуждены полагаться на малые количества полноразмерного белка SMN2, продуцируемого в кратком и нефункциональном варианте.
Апробированные лекарства в настоящее время отсутствуют, и поэтому ценными могут оказаться новые подходы ученых, стремящихся найти оптимальные стратегии лечения пациентов. Исследователи CSHL (Cold Spring Harbor Laboratory ) обнаружили, что препарат для лечения СМА при испытании на мышах эффективен даже при подкожном введении, не обязательно в ЦНС. Показаны срезы спинного мозга трех мышей со СМА. Системное лечение препаратом (средняя панель) повышает количество моторных нейронов (красные точки) по сравнению с мышами, не получавшими препарат (левая панель). Удивительно то, что результаты практически одинаковы и при исключении лечения из ЦНС (правая панель), что говорит о вероятной находке нового пути лечения СМА.
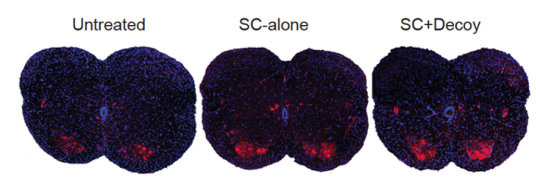
Иллюстрация предоставлена Cold Spring Harbor Laboratory
Профессор Адриан Крейнер из CSHL, совместно с компанией Isis Pharmaceuticals, разработал препарат, позволяющий откорректировать молекулярное редактирование, повышая таким образом количество функционального (полноразмерного) белка SMN2 в нейронах. Препарат, известный как antisense oligonucleotide (ASO), дал обнадеживающие результаты в доклинических испытаниях на мышах со СМА. Сейчас препарат находится в третьей стадии клинических испытаний уже на пациентах со СМА. Препарат вводится непосредственно в спинномозговую жидкость. «У нас принято в основном считать, что SMN необходим скорее центральной нервной системе (ЦНС), нежели периферическим тканям конечностей или печени, так что основные усилия были сконцентрированы на том, чтобы увеличить количество SMN в ЦНС, — объясняет Крейнер, — Однако, в последние несколько лет накопились данные, противоречащие нашим представлениям о патологии этого заболевания. Вопрос в том, должны ли мы увеличивать количество SMN в ЦНС, в периферических тканях, или же и там, и там».
В своей новой работе, о которой сообщается в журнале Genes & Development, ученые разработали способ восстановить продуцирование SMN только в периферических тканях, что позволяет выяснить роль препарата как внутри ЦНС, так и за ее пределами. В рамках хорошо известных процедур они вводили АСО мышам со СМА подкожно. Как и в прежних исследованиях, препарат повышал количество SMN как в ЦНС, так и в периферических тканях. У новорожденных мышей, в отличие от более старших, некоторое количество препарата, введенного периферически, достигало ЦНС. Лечение показало свою эффективность на грызунах.
Затем, одновременно с подкожной инъекцией АСО, в ЦНС вводился олигонуклеотид-«обманка». «Она могла деактивировать препарат только в ЦНС. — говорит Крейнер, — В периферических тканях по-прежнему продуцировался полноразмерный SMN2, причем его количество не увеличивалось в ЦНС, то есть именно там, где, как мы считали, он играет важную роль». Результаты были поразительными и неожиданными. «Мы с удивлением обнаружили, что наша обманка не абсолютно никак не воздействует ни на мотонейроны, ни на восстановление. Вопреки нашим первоначальным предположениям, количество SMN как в ЦНС не влияет на избавление от фенотипов СМА в мышиных моделях этого заболевания».
В практическом отношении данная работа важна для ученых и клиницистов, разрабатывающих оптимальные стратегии лечения СМА. Как говорит Крейнер: «Препарат АСО уже продемонстрировал свой потенциал в условиях клиники. Существует вероятность того, что изменяя способ введения препарата, можно добиться и лучших результатов; может быть и так, что в наших исследованиях отражены некие уникальные отличительные особенности мышиных моделей, но и в таком случае это будет иметь важное значение для понимания основных механизмов».
Источник:
Репринт материалов, предоставленных Cold Spring Harbor Laboratory.
Журнальная публикация:
Yimin Hua, Ying Hsiu Liu, Kentaro Sahashi, Frank Rigo, C. Frank Bennett, and Adrian R. Krainer. Motor neuron cell-nonautonomous rescue of spinal muscular atrophy phenotypes in mild and severe transgenic mouse models. Genes & Development, January 2015 DOI: 10.1101/gad.256644.114

